Numer
3/556/WI/10
Zródło finansowania
Interdyscyplinarny projekt badawczy o charakterze międzyuczelnianym Uniwersytet Medyczny w Poznaniu – Uniwersytet Przyrodniczy w Poznaniu
Kierownik
Aleksandra Łangowska
Celem projektu było opracowanie prostej i dającej powtarzalne wyniki metody badania najistotniejszych parametrów jakości nasienia pszczół – liczby i żywotności plemników. Gatunkami, dla których przeprowadzono próby, były: pszczoła miodna Apis mellifera L. oraz pszczoła samotnie żyjąca, murarka ogrodowa Osmia rufa L. Do badania nasienia pszczół zaadoptowano metodę cytometrii przepływowej, stosowaną do oceny żywotności i koncentracji plemników u zwierząt (ptaków i ssaków), a także w medycynie ludzkiej. Wykorzystany został zestaw barwników fluorescencyjnych SYBR-14 (znakuje żywe komórki) oraz jodek propidyny (PI; znakuje martwe komórki). Barwniki te były z powodzeniem stosowane w ocenie żywotności nasienia pszczoły miodnej, w metodzie polegającej na liczeniu w obrazie spod mikroskopu fluorescencyjnego plemników wykazujących odpowiednio fluorescencję zieloną i czerwoną. Zestaw tych barwników jest używany również do oceny żywotności plemników ssaków metodą cytometrii przepływowej.
W dalszej kolejności planowano określenie liczby plemników w nasieniu pszczół za pomocą cytometrii przepływowej z wykorzystaniem fluorescencyjnych kulek. Gdyby badania się powiodły, metoda ta, stosowana w weterynarii i medycynie, mogłaby zastąpić dotychczas stosowane licznie plemników pszczół pod mikroskopem z kontrastem fazowym, które jest pracochłonne i dające wynik obarczony błędem.
Obie metody mogłyby znaleźć zastosowanie w naukach oraz praktyce zootechnicznej (np. opracowanie metody długotrwałego przechowywania nasienia pszczoły miodnej; realizacja programów hodowlanych). Przewidywaliśmy również szerokie zastosowanie badanych metod w naukach biologicznych.
WYNIKI
Liczba plemników
Zastosowane metody: Barwienie SYBR_14 : IP; kulki fluorescencyjne BD truCOUNT Tubes; cytometria przepływowa
W obrazie właściwym dla plemników kulki są niewidoczne (bądź zasłonięte pod obrazem plemników) – zastosowany zestaw nie nadaje się do zliczania plemników pszczół w cytometrze przepływowym
Żywotność plemników
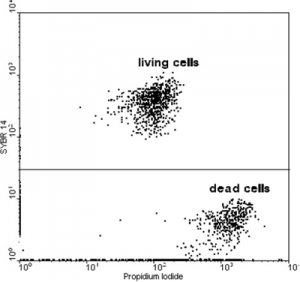
Zastosowane metody: Barwienie SYBR_14 : IP; cytometria przepływowa – wykonano stress test z użyciem metanolu by ustalić położenie martwych komórek na wykresie rozproszenia; ustalono parametry pomiaru; każdy pomiar wykonany dwukrotnie (wysoka powtarzalność wyników; Spearman correlation, rS > 0.70 we wszystkich przypadkach, n = 20, P < 0.001 we wszystkich przypadkach)
W nasieniu obu gatunków pszczół, pobieranym od samców (z pęcherzyków nasiennych; u p. miodnej również z ejakulatu) i matek pszczoły miodnej (ze zbiorniczków nasiennych sztucznie unasienionych matek czerwiących), stwierdzono cztery populacje obiektów: artefakty (nie plemniki), plemniki żywe (zielone), plemniki martwe (czerwone) oraz dużą populację tymczasową plemników dwubarwnych. Na wykresie rozproszenia jednak (w obrazie po zastosowaniu bramki i wyeliminowaniu obiektów będących artefaktami), wyraźnie wyodrębnione są dwie populacje plemników, z których intensywność fluorescencji IP jednej z nich jest co najmniej o rząd wielkości większa od intensywności fluorescencji IP drugiej z nich (Ryc.1). Należy więc przyjąć, że zarówno plemniki zielone, jak i dwubarwne, są komórkami żywymi. Ostatecznie, w 20 próbkach, przeciętnie 3,8% komórek zabarwiło się jedynie jodkiem propidyny, a 96,2% komórek zabarwiło się SYBR-14 (SD = 2.04).
Wyniki kontroli
- Unasienienie matek pszczelich i kontrola czerwienia: czerw prawidłowy.
- Pomiar spod mikroskopu fluorescencyjnego: plemniki zbyt ruchliwe.
- Barwienie hemocytów (hemolimfa pobrana z serca), cytometria: obserwowana bardzo duża populacja hemocytów dwubarwnych.
Badania wymagają kontynuacji: określenie dynamiki zmian w populacji tymczasowej plemników dwubarwnych.
Publikacje
Rzymski P., Langowska A. Fliszkiewicz M., Poniedziałek B., Karczewski J., Wiktorowicz K. (2012) Flow cytometry as an estimation tool for honey bee sperm viability. Theriogenology 77,8: 1642-1647.
